アジドとアルキンとのクリック反応
2つの化合物を確実につなぐ反応は、有機化学においてだけでなく、広範な分野に対して重要な役割を果たしています。とくに、最近は、「化学」に対してだけでなく、「生物学」に対しても革新的な研究手法を提供しています。
生命科学研究において、タンパク質や脂質、糖質などの無数の分子が混在する中で、目的とする分子だけを ”みる” 方法が強く求められています。これに対して、これまで、遺伝子改変による緑色蛍光タンパク質(GFP)の導入をはじめとする生物学的な手法がいくつも開発されてきました。しかし、より汎用性の高い手法として、観察したい生体分子の機能を損なわないように蛍光団などを導入する方法が必要とされています。そのためには、生体分子のごく一部だけを改変し、その部分だけを狙って、確実に変換してやらなければなりません。しかし、水中であっても、共存する無数の生体分子とは反応しないように、目的の変換のみを遂行しなければなりません。
近年盛んに研究されている「クリック反応」(Angew. Chem., Int. Ed. 2001, 40, 2004; Wikipedia)と呼ばれている反応は、このような難しい条件を満たしているため、生体分子を化学修飾する手法として大歓迎されています。
なかでも、銅触媒を用いるアジドとアルキンとの環化付加反応(Cu-Catalyzed Azide Alkyne Cycloaddition: よくCuAACと略されます)が、生命科学研究における新しい手法として汎用されるようになってきました(下式)。
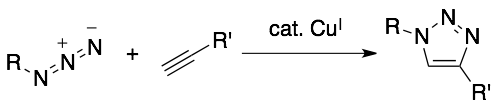
この反応は水中でも問題なく進行し、無数に共存する生体分子があってもほとんど阻害されないため、生体分子の化学修飾に信頼して用いることができます。また、アジドやアルキンが生体内には存在しない(「bioorthogonal」と呼ばれます)官能基であるため、標的とする生体分子が標識するには理想的な反応と言えます。しかも、アジドやアルキンはいずれも無極性で小さく、観察したい系に影響を与えづらいことや、求核性のアミノ酸残基や、酸性・塩基性いずれの条件に対しても比較的安定である点も適しています。従って、観測したい生体分子や薬剤にアジド(あるいはアルキン)部位を導入し、銅触媒とアルキン(あるいはアジド)部位を有する蛍光性化合物を添加することで、標的の分子のみを可視化することができます。現在では、Alexa Fluor®などの蛍光色素において、488 nmから647 nmといった広範な波長の蛍光性官能基を有する多彩なアジド・アルキンが市販されており(invitrogen)、実際に生命科学研究の現場で汎用されるようになっています。
アジドとアルキンとの環化付加反応は、50年以上も昔に発見された反応です。1963年、Huisgenらによって、アジドとアルキンとを100 °C程度にまで加熱すると、1,3-双極子環化付加反応が進行し、位置異性体の混合物ながらトリアゾール環が形成されることが報告されました(Angew. Chem., Int. Ed. Engl. 1963, 2, 565.)。この形式の反応は、Huisgen反応と呼ばれています。
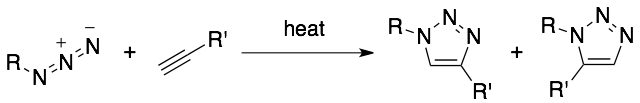
この反応自体は、トリアゾール誘導体の合成において有用であるものの、室温では進行しないため、生体分子の化学修飾法としてはりようできませんでした。それが、2002年になって、Sharplessら(Angew. Chem., Int. Ed. 2002, 41, 2596.)とMeldalら(J. Org. Chem. 2002, 67, 3057.)がそれぞれ独立に、銅塩によってアジドとアルキンとの環化付加反応が著しく(100万倍!)加速されることを見いだしたことで、新たな分子連結法として利用できるようになりました。彼らは、銅塩の添加によって、環化付加反応が室温で進行し、トランス体を選択的に生じることを報告しました。この反応の有用性はあっという間に世界中に広がり、多くの研究者に利用され、この反応が「クリック反応」の代表格として認識されるようになってきて、今に至ります。その後も反応条件が改良されてきた結果、銅触媒を用いるアジドとアルキンとのクリック反応が生体分子を標識する手法としても重要な役割を担うようになってきました。その有用性は上述の通りです。しかしながら、本反応にも弱点があります。ひとつは、触媒である銅塩が細胞などへの毒性を有する点です。さらに、反応速度の点でも未だ充分とは言えず、もっと速い反応が求められていました。
こういった歴史を経て、クリック反応は生命科学研究に有用なツールとしての地位を確立してきましたが、最近になって、銅触媒を用いなくても進行するアジドとアルキンとのクリック反応が新手法として注目され、目まぐるしい進展を遂げています。2004年、Bertozziらは、歪みの大きな環状アルキンを用いることで、アジドとの環化付加反応が、室温においても銅触媒なしで速やかに進行することを報告し、このアルキンが生体分子の化学修飾において有用であることを見いだしました(J. Am. Chem. Soc. 2004, 126, 15046.)。

この発見を契機にして、複数の研究グループによって新たな環状アルキンが相次いで合成され、反応の高速化が達成されてきました(下図)。とくに、細胞毒性のある銅触媒を用いずにすむだけでなく、反応速度が大きく向上したことも重要です。こういった進展の結果、本手法を利用し、生きた動物中での標的分子の観察(in vivo イメージング)も達成されました。このように、歪んだ環状アルキンを利用した銅触媒なしでのクリック反応が、生体分子を化学修飾する手法として優れていることが広く認知され、CuAACに代わる、新たな化学修飾法になりつつあります。

最近では、蛍光団などを有するジベンゾシクロオクチン誘導体が市販されるようになったため(invitorogen; Click Chemistry Tools)、生物学者が簡単に利用できる手法になりつつあります。しかし、市販品で上手くいかない場合に、蛍光団とアルキン部位とをつなぐリンカー部位などを観察したい系に応じて検討するためには、その都度、新たに環状アルキンを合成する必要があります。これに対して我々は、より有用な化学修飾法として、生物学者が簡便に条件検討できる手法を開発しました。具体的には、高い反応性を持ったアルキン部位と、蛍光などの付与したい機能を分離し、これらと標的のアジドとを一挙に連結できれば、汎用性の高い手法になると期待したわけです。
上述したように、歪んだ環状アルキンを利用した化学修飾法が汎用されるようになってきました(Strain-Promoted Alkyne Azide Cycloaddition: SPAACと略され、利用されています。)この環状アルキンとアジドとが触媒や加熱なしに速やかに反応するという素反応自体も、古くに報告された反応でした。1961年に、WittigとKrebsによって、シクロオクチンとフェニルアジドとを混合するだけで反応すること自体は報告されていました(Chem. Ber. 1961, 94, 3260.)。しかし、天然物合成に代表されるような「目的の分子を合成する」化学においては役に立つ場面がほとんどありませんでしたが、「目的とする機能同士を連結する」ためには優れた手法であったために、上述したような革新をもたらしたと考えられます。
クリック反応は、「シートベルトをカチッとつなげるように2つの分子を簡単につなげる手法」として、2001年にSharplessらによって提唱されました。彼らの主張は、望みの「機能」を持った化合物を生み出すための究極の手法は、確実に進行する反応である、と解釈できます。上述したアジドとアルキンとの反応はその代表例と言えるわけですが、CuAACの原型である熱的なHuisgen反応自体はトリアゾールの合成法としてしか認識されていませんでした。従って、トリアゾールが欲しいわけではない人には無縁の反応だったわけです。しかし、現在では、2つの部位をつなぐための反応として、極めて重要な位置を占めています。とくに、高分子であったり、無数の混合物が混在した生体分子であったり、といった確実に反応させること自体が簡単でない上に、狙った通りに反応したかどうかの解析も容易でない場合には極めて有効で、なくてはならない手法になったと言えます。もしかしたら、トリアゾールを合成しているとは知らずに、この反応を使っている研究者がいるかもしれないと思える程です。このようなクリック反応の躍進は、新たに生み出された反応が、目的の分子の合成法という各論としてだけではなく、新しい価値観を提示しつつ、新たな手法を幅広い分野に提供した稀有な例として捉えることもできます。



