ベンザイン化学への取り組み
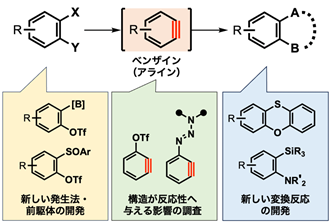
私たちは、ベンゼン環の一部が三重結合になった「ベンザイン(アライン)」に心惹かれて研究に取り組んでいます。ベンザインは単離困難な高反応性化学種であることから、どういった条件でベンザインを発生させるか、が目的の変換の成否を分けます。これに対して、私たちは(A)新しい前駆体・発生法の開発から(B)置換基や縮環によるベンザインの反応性への影響、(C)ベンザイン中間体を活用した新規合成反応、新たな反応相手との新しい分子変換、といったベンザイン科学の各局面に関して一貫して研究しています。加えて、ベンザインそのものは分子模型を組めない、歪んだ化学種ですが、計算科学も併せて利用し、反応性の予測・実験結果の解釈に役立てています。
1. ベンザイン = 多能性中間体
ベンザインを経由することで、共通の出発原料から、ナフタレン環やインドール環といった多彩な重要骨格を効率よく構築できたり、従来法ではつくりづらい置換形式の芳香族化合物を短工程で合成できたりします。こういった特徴から、私たちは、ベンザインが多様な化合物へと姿を変えられる、「多能性中間体」であることに着目して、最近研究を展開しています。とくに、ベンザインを経由して合成できる芳香族化合物は、クロスカップリング反応などでは合成困難なものも多く、従来法と相補的に利用できると期待されます。
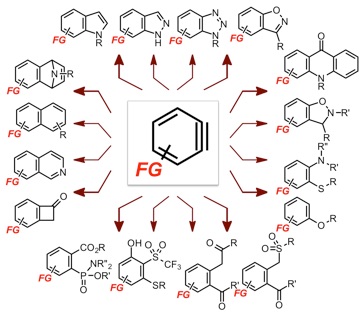
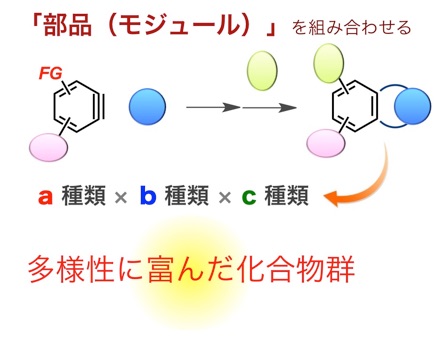
しかも、さらなる変換が可能な官能基をベンザインの構造中に配置しておくことで、複雑な化合物の「モジュラー合成」を容易に行えます。具体的には、部品(モジュール)を組み上げるように標的化合物を合成できることから、ベンザイン前駆体をa種類、ベンザインとの反応相手をb種類、クロスカップリング反応やHuisgen環化付加反応などの引き続く反応で利用する化合物をc種類用意すれば、これらの組み合わせを変えていくだけでa×b×c種類と、多数の化合物が合成できるわけです。この際、ベンザインを利用した反応では、多彩な反応相手を利用できる上に、引き続く反応で利用するハロゲンやアルキンといった部位を損なわずにさまざまな生成物を得ることができます。そのため、モジュラー合成法を利用することで、多様性に富んだ化合物群を簡便に合成できることから、「化合物ライブラリー」の構築に有用です。

2. 多様性指向型合成による化合物ライブラリー構築:マシンガンの弾のように化合物を使う研究とそのための合成反応
亀の甲で表される「ベンゼン」は化学のシンボルです。このベンゼン環は医薬品や有機材料といった暮らしに役立つ有機化合物の基本骨格でして、天然に存在する多種多様な分子や、美しい幾何学模様をした人工分子といった、いろいろな芳香族化合物が実際に合成され、その性質が調べられています。前述した「ベンザイン」中間体は、これまで、合成難易度の高い、複雑な芳香族化合物の骨格を構築する際に有用であることが明らかにされてきました。たとえば、細谷教授が学生時代に実際にたずさわった、抗腫瘍性化合物Gilvocarcin類の合成(T. Matsumoto, T. Hosoya, K. Suzuki, J. Am. Chem. Soc. 1992, 114, 3568; T. Hosoya, E. Takashiro, T. Matsumoto, K. Suzuki, J. Am. Chem. Soc. 1994, 116, 1004. )は、ベンザイン中間体を経る合成戦略が功を奏した代表例です。その鮮やかな合成は、Classics in Total Synthesisにも収載され、絶賛されています。また、ベンザイン中間体を経由すると、通常は合成の容易でない四員環構築も高効率で行えます(T. Hosoya, T. Hasegawa, Y. Kuriyama, T. Matsumoto, K. Suzuki, Synlett 1995, 177.)。そのため、美しい人工化合物の合成にも役立ってきました(T. Hamura, Y. Ibusuki, H. Uekusa, T. Matsumoto, J. S. Siegel, K. K. Baldridge, K. Suzuki, J. Am. Chem. Soc. 2006, 128, 10032.)。このように、ベンザイン中間体を経る手法は、難関標的化合物の合成を可能にしてきたことから明らかであるように、「標的指向型合成(Target-oriented Synthesis)」を進めるための有力なツールとして利用されてきたわけです。

その一方で、最近、「多様性指向型合成(Diversity-oriented Synthesis)」(M. Burke, S. Schreiber, Angew. Chem., Int. Ed. 2004, 43, 46.)という考えにもとづいた有機合成に注目が集まっており、この際も、ベンザイン化学が役立つと私たちは考え、研究に取り組んでいます。とくに、こうした観点で構築される「化合物ライブラリー」が創薬研究などにおいて、ますます重要な役割を果たすようになってきました。「化合物ライブラリー」は、「くすり」の開発をはじめとする、「化合物に望む機能は明らかだけど、さて、どんな構造の分子を合成したものか…」という場面で、近年重要な役割を果たすようになってきました。すなわち、新しい「くすり」の探索のような、理詰めで、ピンポイントに狙い撃つことはできない場合に、マシンガンが如く、多数の化合物を試し、その中から望みの機能をもった化合物を探してやろう、という使い方で化合物ライブラリーが役立っています。

実際に、未だに治療法のない疾患を治癒させるような、生体機能を制御する革新的な「くすり」が、世界中の創薬研究者によって探索されています。私たちの共同研究者たちも、熱い想いを胸に、独自の着眼点のもと、斬新な創薬ターゲットを制御する化合物の探索、さらには、その機構の解明に取り組んでいます。 さて、未解明の生命現象を対象にした「くすり」はどのようにして見いだされるのでしょうか? 疾患の機構や標的タンパク質が不明な場合も多く、せっかく化合物の生物活性を調べられる態勢が整っても、候補の化合物たちがなければ話は始まりません。これに対して、近年のスクリーニング技術の向上に伴い、前述したように、大規模な化合物ライブラリーを利用したスクリーニングが重要になってきました。たとえば、大学の研究室の規模でも、対象となる疾患のモデルに対して1万種類を超える化合物を試し、その中から生命現象を制御する新しい化合物たちが見つけられたりします。こういった、ときには数百万種類にものぼる「くすり」候補化合物たちとして、化合物ライブラリーが利用されています。最近は、全国で共用できる化合物ライブラリーの整備も進み、アカデミアの研究者でも気軽に化合物ライブラリーを利用するスクリーニングが行えるようになってきました。私たちの所属する東京医科歯科大学 生材材料工学研究所も2万種類をこえる化合物ライブラリーを保有しており、実際、これらの中から斬新な生物活性化合物が見いだされています(医療機能分子開発室)。さらに、私たちが参画している国家プロジェクトである「創薬等支援基盤プラットフォーム事業」を進めている拠点機関のひとつ、東京大学オープンイノベーションセンターには20万種類以上もの化合物が集められ、この化合物ライブラリーを起点とする創薬研究が活発に行われつつあります。こういった化合物ライブラリーに研究室で生み出される新分子たちを登録し、これらが実際のスクリーニングに提供される、という仕組みが既にできあがっており、こういった背景から、さまざまな骨格・置換形式の化合物群を簡便に合成する手法が待ち望まれています。
これに対して、私たちは、ベンザインを共通した合成中間体として用いれば、多様性に富んだ、多置換あるいは縮環型のベンゼン類を簡便に合成できると考え、研究に取り組んでいます。具体的には、前述した「モジュラー合成による多様性に富んだ化合物群の創出」を念頭に、新しいベンザイン前駆体および発生法の開発や、変換可能な官能基を有するベンザイン、縮環型のベンザイン、といった新しい合成素子(モジュール)の開発、さらには、従来のベンザイン変換法だけでなく、新しい形式の変換法に至るまで、幅広い切り口でベンザインを研究しています。このベンザイン化学では、面白い発想にもとづく分子設計が、独自な手法の開発に簡単に結びつく点が特長で、実際、多彩な元素の特性を活かし、いろいろな変換反応の開発に日々取り組んでいます。
3. ベンザインの反応性: 2πとしても、求電子剤としても、超高反応性
ベンザインは、ベンゼン環の一部が三重結合となった化学種であり、極めて不安定なため単離することはできません。したがって、本当にアルキンのような構造なのか、確認することは困難です。これまで、同位体標識実験(J. D. Roberts, et al., J. Am. Chem. Soc. 1953, 75, 3290.)やベンザインと金属塩との錯体の構造解析(M. A. Bennett, et al., Organometallics 1985, 4, 1992.)などから、ベンザインの存在そのものが明らかにされてきました。最近は、密度汎関数(DFT)法を用いた理論計算により、ベンザインの反応性を精密に予測できるようになっています(N. K. Garg, K. N. Houk, et al., J. Am. Chem. Soc. 2014, 136, 15798; etc.)。ただ、いまだに、「ベンザインの反応性に関する理解が飛躍的に進んできた」とは言いがたい現状です。そのため、ベンザインを経る変換反応が、一般的な有機合成手法としてさまざまな場面で利用される日は、まだすぐには訪れそうにありません。
ベンザインを経る合成反応は、近年、世界中から報告されるようになってきました。こういったベンザインの変換法に関して、古くから活発に研究されてきました。とくに、ベンザインの性質に関しては、1967年(約50年も昔!)に発刊された名著 “Dehydrobenzene and Cycloalkynes(R. W. Hoffmann 著)” で深く、そして、幅広く考察されています。ただ、当時は、効率的かつ基質適用範囲の広い、「合成的に有用」といえる変換法は決して多くありませんでした。この頃は、ベンザインの反応性に関する興味から、多彩な変換にもとづく生成物が低収率ながら見いだされ、その結果から「ベンザイン」という活性種が秘めている反応性が手探りで研究されていたわけです。多数の研究の成果として、以下のような反応性が明らかにされました。
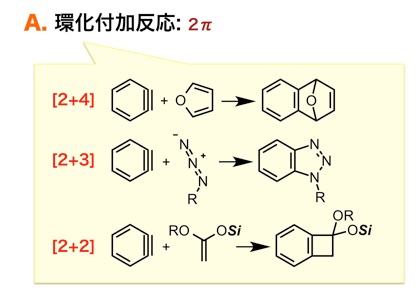
A. ベンザインは「 2π 」として環化付加反応に利用される
協奏的な環化付加反応において、ベンザインは高い反応性を示します。 たとえば、Diels–Alder反応。初等の教科書で学習するような基本的な反応であるものの、ジエンなどの「4π」とアルケンやアルキンなどの「2π」を混ぜるとなんでも反応するわけではありません。一般的に、電子豊富なジエンと電子不足なアルケンとの反応例が多く、相性の良くない組み合わせの場合には高温での加熱を必要としたり、まったく反応しなかったりします。また、組み合わせが逆の反応は「逆電子要請型」と呼ばれたりもします。 さて、ベンザインに話を戻します。電子豊富なジエンといった4π系化合物(フラン類など)の存在下、ベンザインを発生させると、–78 °Cといった極低温でもDiels–Alder反応することが知られています(G. Wittig, L. Pohmer, Angew. Chem. 1955, 87, 348; T. Matsumoto, T. Hosoya, M. Katsuki, K. Suzuki, Tetrahedron Lett. 1991, 32, 6735; etc.)。このような協奏的な反応におけるベンザインの反応性はとても高く、他にも、アジドやニトロンなどの1,3-双極子などとも効率よく環化付加します(G. A. Reynolds, J. Org. Chem. 1964, 29, 3733; etc.)。さらに、機構には議論の余地が大きく残されていますが、ケテンアセタール、アルケニルエーテルなどとの[2+2]型の環化付加反応も高効率で進行することから、ベンゾシクロブテンの効率的な合成法としても利用されています(T. Hosoya, T. Matsumoto, K. Suzuki, et al., Synlett 1995, 177; etc.)。
B. ベンザインは反応性の高い求電子剤
ベンザインは、求電子剤としても高い反応性を示します。たとえば、アミンやチオールなどを効率よくアリール化できます(R. Huisgen, J. Sáuer, Angew. Chem. 1960, 72, 91; etc.)。また、有機金属試薬とも反応することから、両オルト位にアリール基を有するチオエーテルなどの合成に利用されてきました(T. Bally, R. S. Glass, et al., J. Org. Chem. 2010, 75, 8363; etc.)。さらに、ときには、溶媒として用いるようなエーテル類の付加さえ進行します(E. Wolthuis, Tetrahedron Lett. 1970, 11, 407; H. Yoshida, et al., Angew. Chem., Int. Ed. 2011, 50, 9676; etc.)。 ベンザインに求核剤が付加すると、アリールアニオン中間体を与えます。ここから、1)適切な求電子剤との反応によって安定な分子へと変換される、2)求核剤がβ脱離して再度ベンザインが発生する、3)系中で発生したベンザインへと攻撃し、再度アリールアニオン中間体を与える、という3種類の経路に分岐します。このとき、効率的に目的とする分子へと変換するためには、3)を避けて、1)を進行させるような反応条件を設定する必要がありますが、ベンザイン(アライン)の反応相手(アライノフィル)として求電子的な部位を併せ持つ求核剤を用いた場合には、σ結合の切断を経る独特の変換が実現できるため、近年、このタイプの反応も活発に開発されてきました(P. Caubere, D. N. Derozier, B. Loubinoux, Bull. Soc. Chim. Fr. 1971, 302; H. Yoshida, et al., Chem. Commun. 2005, 3292; U. K. Tamber, B. M. Stoltz, J. Am. Chem. Soc. 2005, 127, 5340; etc.)。

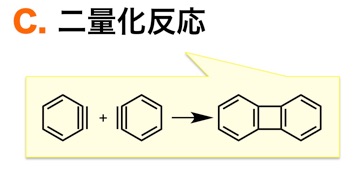
C. ベンザインは二量化する
ベンザインの二量化([2+2]反応)によってジベンゾシクロブタジエンが生じることも知られています。この反応は、共存する分子との不可逆な変換がほとんどない条件で、ベンザインを高濃度で発生させた場合に進行すると考えられます。こういったベンザインの性質は、ラジカル反応における炭素ラジカルの性質に似ていますね。
このように、高い求電子性ゆえに、ベンザインをうまく制御して効率的な変換を実現することは容易ではありませんが、ベンザイン中間体には多彩な変換を可能にする魅力が潜在的に備わっているため、長年、有機化学者たちの興味を惹きつけてきました。
4. 有機合成に役立つ、ベンザインの新しい前駆体
現在作成中・・・
5. さまざまな置換基を3位に有するベンザインの反応性
現在作成中・・・



