タンパク質などの生体分子を効率良く化学修飾するために、生体内に通常は存在しない(bioorthogonalな)官能基同士で速やかに進行する反応が有用です。これに対して当研究室では、高度に歪んだアセチレン結合を二つ有するジイン化合物に着目し、これを用いる生体分子の化学修飾法について研究を行っています。最近、歪んだジイン化合物とアジド化合物との二度の付加環化反応が速やかに進行することを見いだし、この反応を「ダブルクリック反応」と命名しました。さらに、この反応を利用することで、生体分子・蛍光性小分子とをジインを介して効率良く連結できることを明らかにしました。本法は、入手容易な小分子で生体分子をラベル化できる簡便な新手法であり、現在、修飾効率の向上や新たな利用法への展開を目指し、研究を進めています。
ダブルクリック反応
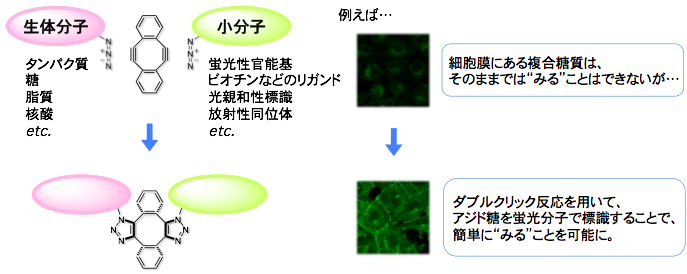
近年、生体分子を標識する画期的な手法として、銅触媒を用いないクリック反応が汎用されるようになってきました(詳細はこちら)。 この手法では、分子模型を組むのが困難なくらいに歪んだ環状アルキン(シクロオクチン)を利用すると、アジドとの環化付加反応が触媒なしでも円滑に進行することが鍵となっています。
この研究成果を受けて、早速、蛍光性などの機能を持った環状アルキンが市販されるようになり、その結果、生命科学者が利用できる手法になりました。 具体的には、観察したい生体分子に生物学的な手法でアジド基を導入した後(代謝経路を利用し、アジド糖を糖鎖に導入したりします)、例えば、これを蛍光性の歪みアルキンで標識し、蛍光顕微鏡で観察する、というように使われています。 しかし、本手法は様々な場面で利用できる優れた手法ではありますが、市販されている機能性環状アルキンの種類が限られており、研究目的に応じて環状アルキンをその都度合成する必要があります。
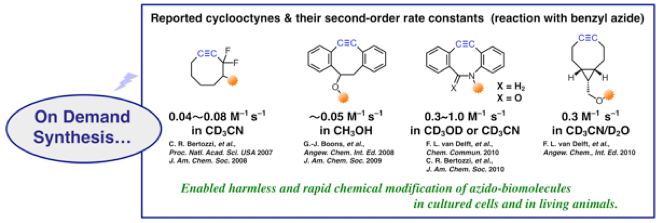
例えば、目的の生体分子以外も蛍光標識されてしまったり(疎水性部位とタンパク質との相互作用によって、アジドを持たない生体分子にもくっついてしまったりします)、観察時の褪色(励起光によって蛍光性化合物は徐々に分解します)を緩和したい場合、適切な蛍光性部位を選ぶことで問題点を解決できるかもしれません。 しかし、市販されていない環状アルキンを入手するには、高度な化学合成が必要になります。腕の立つ有機化学者であれば難なく合成できる化合物かもしれません。 とは言っても、例えば、環状アルキン部位と蛍光性の部位との組み合わせを変え、さらに親水性を高めるように連結部を変え、目的の現象を観測するために詳細に検討したい場合はどうでしょうか? 多数の目的化合物を合成・精製し、これらを提供するためには、どうしてもかなりの手間ひまがかかってしまいます。 従って、生命科学研究の速度を飛躍的に向上させるためには、研究現場で利用しやすい新手法が待ち望まれています。
これに対して我々の研究グループは、生体分子への導入が容易なアジド基と蛍光性分子等の小分子アジドとを、2ヶ所の歪んだアルキン部位でつなぎ合わせる新手法「ダブルクリック反応」を考案しました。具体的には、2ヶ所の歪んだアルキン部位を2つのベンゼン環で架橋したSondheimerジインに着目しました。すなわち、ジインとアジドとの2度のクリック反応が銅触媒なしでも速やかに進行し、生体分子アジドと小分子アジドとをジインを介して連結できると考えたわけです。

このジインは、1974年にSondheimerらによって初めて合成された化合物です(J. Am. Chem. Soc. 1974, 96, 5604.)。その興味深い構造が注目され、電気化学的な挙動(J. Am. Chem. Soc. 1976, 98, 5560.)やDiels-Alder反応における高い反応性(Tetrahedron 1981, 37, 99.)などが明らかにされました。その後、他の研究者らによって、その構造的な特長を活かし、歪んだアルキン部位を配位子とする金属錯体(R. Gleiter et al., J. Organomet. Chem. 2006, 691, 1814; M. Tanaka et al., lnorg. Chim. Acta 1997, 265, 1; etc.)、筒状化合物(R. Gleiter et al., Chem. Eur. J. 2009, 15, 3380.)、テトラフェニレン類(A. Sygula et al., J. Am. Chem. Soc. 2007, 129, 3842.)などが合成されてきました。さらに、大寺先生らによってSondheimerジインの簡便合成法が開発されました(Chem. Eur. J. 2002, 8, 2000.)。本合成法は、市販のアルデヒドから2段階、ワンポットで効率よくジインが合成できるという優れた手法です。そこで、我々もその合成法に従い、ジインを合成し、ダブルクリック反応の検討に着手しました。なお、このジイン、一見すると不安定で取扱いに難がありそうですが、実際は水や光、空気、シリカゲル、弱い酸や塩基などにはそれほど敏感ではありません。長時間、空気中で放置しておくと、徐々に分解してしまう程度の不安定さで、気軽に利用できる化合物です。
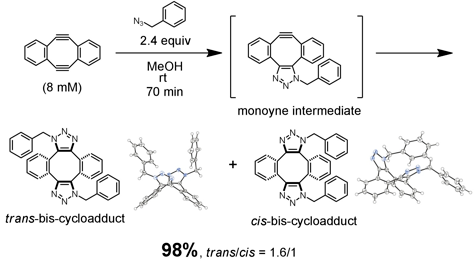
我々は、まず、室温において、ジインのメタノール溶液(8 mM)に2.4当量のベンジルアジドを加えてみました。その結果、期待したとおり2度のクリック反応が速やかに進行し、2重付加体がシス体・トランス体の混合物としてほぼ定量的に得られました。なお、得られたビストリアゾールの構造はX線結晶構造解析によって確認しております。さらに、本反応の反応速度定数を求めたところ、0.06 M–1s–1でした。これは、ジインを用いるダブルクリック反応が、既存の歪んだアルキンを用いた場合と同等の反応性を有していることを示す結果です。
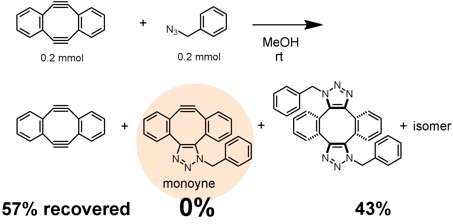
次に、2度のクリック反応を1段階ずつ行おうと考え、ジインのメタノール溶液(8 mM)に等量のベンジルアジドを加えたところ、ビストリアゾールが得られるとともに、未反応で残ったジインが回収されるのみで、モノインは確認できませんでした。さらに、–78 °Cで反応させても、モノインは得られず、ビストリアゾールが生じるのみでした。すなわち、2度目の反応は、1度目の反応よりもずっと速く進行することが明らかになりました。
2度目のクリック反応が1度目のクリック反応よりも速いことは、理論計算からも確認することができました。すなわち、密度汎関数理論(DFT)法でアジドとジインとの反応の経路を調べたところ、2度目の反応の活性化エネルギーの方が1度目の反応の活性化エネルギーよりも充分に小さいことを示すことができました。これは、ベンゼン環とトリアゾール環の置換基との立体反発によって、シクロオクチン環が平面構造を崩し、アルキン部位の歪みが増したために生じた結果であると考えています。
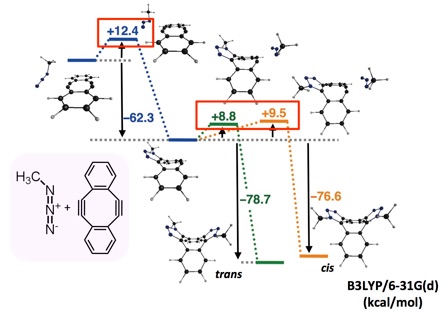
段階的に2度のクリック反応を行うことはできませんでしたが、生体分子の化学修飾のモデルとして、2種類のアジドとジインとを反応させることで、ジインを介して2種のアジド化合物をつなぐことができました。
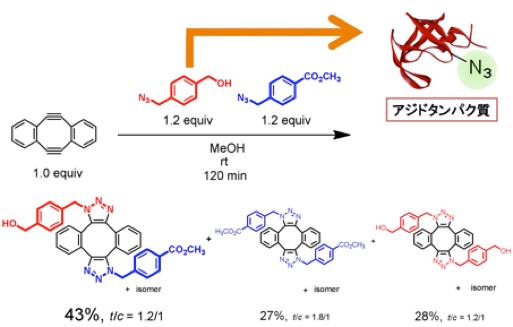
そこで、一方のアジド化合物としてアジド基を導入したタンパク質を用いて、ダブルクリック反応によって蛍光性アジドとの連結を試みました。

具体的には、まず、「HaloTag」と呼ばれる部位を有するタンパク質を作成しました。これにアジド基を有するクロロアルカン(HaloTagリガンド)を作用させると、HaloTag部位とHaloTagリガンドとの間で共有結合(エステル結合)を結合形成することを利用し、アジド基を有するタンパク質を準備しました。次に、このタンパク質と蛍光性アジド化合物とを共存させた水溶液に対してジインを加えました。その結果、分子量の違いによる分離を利用した解析(SDS-PAGE)や質量分析法(MALDI-MS)による解析から、目的のタンパク質を蛍光性アジド化合物で効率よくラベルできることが明らかになりました。さらに、アジドタンパク質に対して、ジイン、蛍光性アジドの順で加えていったところ、予期に反して、この場合も効率よくタンパク質をラベルできることが分かりました。すなわち、小分子のときには2度目の反応の方が1度目の反応の方がずっと速かったため、タンパク質2分子がジインと反応した生成物が生じると予想していましたが、そのような生成物はわずかにしか確認できませんでした。
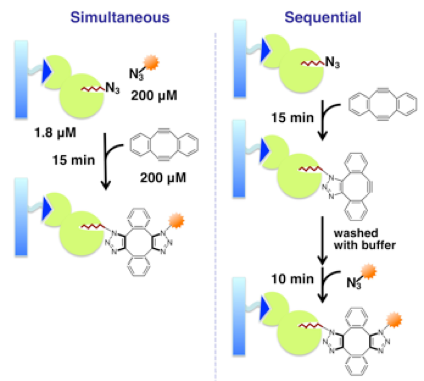
さらに、ダブルクリック反応は、生きた細胞においても利用できる手法であることを明らかにしました。すなわち、細胞膜表面の糖鎖部位にアジド基を配した細胞を準備し、ジイン、蛍光性アジド化合物の順に作用させたところ、細胞膜表面を効率よく蛍光ラベルすることができました。この結果から、無数の分子が存在する系であっても、ジインやモノイン中間体の歪んだアルキン部位とアジド基との反応が優先して進行することが明らかになりました。しかも、従来の歪んだ環状アルキンを用いるタンパク質の蛍光ラベルも行い、今回開発したダブルクリック法による蛍光修飾効率と比較したところ、同程度の効率でラベルできることも分かりました。

以上のように、2つの歪んだアルキン部位を有するSondheimerジインを用いることで、生体分子アジドと小分子アジドとの2度のクリック反応、すなわち、ダブルクリック反応が円滑に進行することを見いだし、これが生体分子の化学修飾法として有用であることを明らかにしました。従来法は生体分子アジドと小分子アルキンとをつなげる方法であるのと比べて、本手法は生体分子アジドと小分子アジドとをつなぐことができる新しい方法であると言えます。従って、ジインを共通して用いることで、合成が容易であり、かつ、多数が市販されているアジド化合物が利用できるため、歪みアルキンの合成・精製の手間を省くことができます。さらに、多彩なアジド化合物を利用し、あたかも「カチカチッ」っとダブルクリックするかのように生体分子アジドとつなぎ合わせることができるため、実際に生体分子を化学修飾する際の検討も簡単になります。このように、ダブルクリック法は一度で二度美味しい、一挙両得な手法であり、生命科学研究を加速させることができると自負しています。



